酪蛋白磷酸肽功能(néng)性質(zhì)的體(tǐ)外研究
馮鳳琴 許時嬰 王璋
(無錫輕工(gōng)大學(xué)食品學(xué)院,無錫,214036)
摘要:以酪蛋白為(wèi)原料,通過有(yǒu)控制的酶解以及離子交換和凝膠過濾技(jì )術制得N/P(摩爾比)不同的酪蛋白磷酸肽(CPPs),并對其體(tǐ)外阻止磷酸鈣沉澱的效果進行了分(fēn)析,測定和比較,在添加量相同時,總的趨勢是N/P較小(xiǎo)的樣品阻止磷酸鈣沉澱形成的效果好于N/P值較大的樣品。CPPs的作(zuò)用(yòng)效果不僅與N/P值有(yǒu)關,還和它們分(fēn)子中(zhōng)氨基酸的組成和排序或磷酸基的分(fēn)布有(yǒu)關。
關鍵詞:酪蛋白磷酸肽,N/P值,磷酸鈣沉澱
In Vitro Study of the Function Properties of Casein Phosphopeptides(CPPs)
Feng Fengqin Xu Shiying Wang Zhang
(School of Food Science,Wuxi University of Light Industry,Wuxi,214036)
Abstract CPPs with different molar ratio of nitrogen to phosphorus(N/P) were obtained through hydrolyzing casein enzymatically,ion exchange chromatography and gel filtration chromatography.The effects of the various CPPs on ratarding the foemation of calcium phosphate precipitate were determined and compared.The results showed that CPPs with lower N/P were more effective than that with higher one.The amino acid composition and sequence of the peptides(or distribution of phosphoryls)as well as the N/P determine the function effects of CPPs.
Key Word casein phosphopeptides,N/P value,calcium phosphate precipitate
酪蛋白磷酸肽(casein phosphopeptides,簡稱CPPs),是由酪蛋白經酶水解、分(fēn)離、純化而制得的含有(yǒu)成簇的成簇的磷酸絲氨酰(phosphoseryl)的肽。在動物(wù)腸内PH呈中(zhōng)性到弱堿性的環境下,CPPs能(néng)阻止磷酸鈣沉澱的産(chǎn)生,使溶解鈣保持在高水平,從而促進鈣的吸收和利用(yòng)[1,2]。CPPs的生理(lǐ)活性由其分(fēn)子中(zhōng)氨基酸的組成和排序(或磷酸基的分(fēn)布)決定。CPPs的N/P摩爾比可(kě)反映CPPs的純度和磷酸基密度,N/P較低,則純度或磷酸基密度較高。純度不同或磷酸基密度不同的CPPs結合鈣的能(néng)力也不同。本研究通過控制酪蛋白的酶解程度及離子交換色譜和凝膠過濾色譜制得的N/P不同的CPPs,并對其體(tǐ)外結合鈣的能(néng)力進行分(fēn)析,測定和比較。
1. 材料與方法
1.1 不同N/P的CPPs樣品的制備
向15%的酪蛋白溶液中(zhōng)加入胰酶(蘇州吳縣西由生物(wù)制品廠),于37℃、PH8.0反應至DH(水解度)達8%以上,用(yòng)HCl調PH至4.5,離心除去沉澱,在上清液中(zhōng)加入氯化鈣和乙醇,使其終濃度分(fēn)别為(wèi)1%(w/v)和50%,離心所得沉澱經冷凍幹燥得樣品F,真空幹燥沉澱所得樣品為(wèi)A。
在胰酶作(zuò)用(yòng)結束後,加入微生物(wù)中(zhōng)性蛋白酶(無錫酶制劑廠)繼續作(zuò)用(yòng),使第二次酶解的DH達2%以上,用(yòng)HCl調PH至4.5,離心後棄沉澱,在上清液中(zhōng)加入氯化鈣和乙醇,使其終濃度分(fēn)别為(wèi)1%(w/v)和50%,離心所得沉澱經冷凍幹燥即為(wèi)樣品B。
1.2 樣品A和B的純化
樣品A和B中(zhōng)仍然含有(yǒu)一些非磷酸肽(non-phosphopeptides,簡稱NPPs),NPPs的去除采用(yòng)離子交換法。采用(yòng)的離子交換劑為(wèi)大孔強堿性陰離子交換樹脂D290(南開大學(xué)化工(gōng)廠生産(chǎn)),離子交換柱規格為(wèi)50×5.5(cm)。首先将樹脂由Cl型轉為(wèi)Ac型,用(yòng)冰乙酸将6%的樣品A或B的稀溶液的PH調至5.5,以300ml/h的速度将樣品上柱。上樣後,用(yòng)去離子水洗去未被吸附的物(wù)質(zhì),再用(yòng)0.2NHCl将被吸附的CPPs洗脫下來。洗脫液用(yòng)NaOH中(zhōng)和後,幹燥即得樣品A’或B’。
1.3 凝膠過濾色譜
經過離子交換色譜純化後的樣品A’和B’組成仍很(hěn)複雜,還可(kě)根據其性質(zhì)分(fēn)成不同的組。用(yòng)凝膠過濾色譜可(kě)将CPPs再按分(fēn)子量大小(xiǎo)進行分(fēn)組,所采用(yòng)的凝膠為(wèi)SephadexG-25,凝膠柱規格為(wèi)100×2.6(cm),洗脫液為(wèi)0.01N的HCl。上樣前調節樣品液的PH至2.0,若有(yǒu)渾濁需過濾除去沉澱,洗脫速度為(wèi)40ml/h。
1.4 總氮、總磷的測定
總氮用(yòng)凱氏定氮法測定。總磷的測定參考Morrison的快速微量定磷法[3]。将幹燥至恒重的分(fēn)析純KH2PO4配成含磷10㎍/ml的标準溶液,分(fēn)别吸取0.0、0.1、0.2、0.4、0.6、0.8、1.0ml于10ml硬質(zhì)刻度試管中(zhōng),用(yòng)去離子水補加至1.0ml,置于105~110℃烘箱中(zhōng)烘幹,加入0.3ml濃H2SO4,于電(diàn)爐上加熱至沸,稍冷後加入一滴H2O2,繼續加熱。滴加H2O2的過程可(kě)重複進行直至試管中(zhōng)溶液無色、澄清為(wèi)止。繼續加熱5min,冷卻後加水至3ml,加入16.5%的NaSO30.1ml,搖勻後,加入1ml12%的钼酸铵溶液,立即搖勻,再加入0.5ml濃度為(wèi)20㎎/ml抗壞血酸溶液,混勻後,在沸水浴中(zhōng)加熱10min,冷卻後,用(yòng)去離子水定容至5.0ml(試管刻度需預先标定),于822nm比色,以含磷量為(wèi)橫坐(zuò)标,OD822值為(wèi)縱坐(zuò)标,繪制标準曲線(xiàn)。樣品溶液稀釋至含磷1~10㎍/ml,按上法顯色,以1.0ml去離子水代替樣品液作(zuò)為(wèi)空白。
1.5 不同N/P的CPPs阻止磷酸鈣沉澱形成的效果比較
CPPs阻止磷酸鈣沉澱形成的效果用(yòng)PH-Atat法檢測[4]。在反應器中(zhōng)加入适量的NaH2PO4和CPPs使兩者在500ml反應體(tǐ)系中(zhōng)終濃度分(fēn)别為(wèi)0.008mol/L和0.0或0.1或0.2g/l。溶液保溫至25℃後加入CaCl2,使之終濃度達0.008mol/L。此時立即用(yòng)0.1N NaOH将反應體(tǐ)系PH調至7.2并不斷滴加0.1N NaOH,使PH保持在7.2。從調節PH即開始計時,PH調至7.2約需2min。從2min開始連續記錄0.1N NaOH的消耗量。以時間為(wèi)橫坐(zuò)标,0.1N NaOH的消耗量為(wèi)縱坐(zuò)标作(zuò)圖。
2 結果與讨論
2.1 離子交換色譜
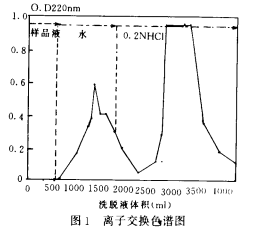
圖1為(wèi)一典型的離子交換色譜圖,在前述色譜條件下對CPPs樣品進行純化,得到兩個峰,經檢測第一個峰不含磷,即為(wèi)NPPs,第二個峰即為(wèi)得到了純化的CPPs。
2.2 凝膠過濾色譜
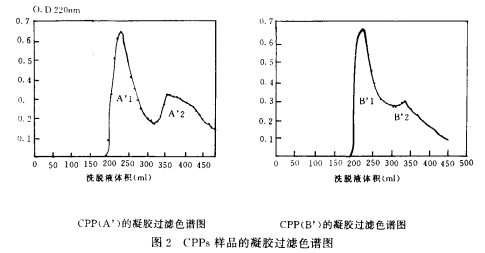
經離子交換色譜純化後得到的樣品A’和B’再經凝膠過濾都出現兩個峰,如圖2所示。從樣品A’得到樣品A’1和A’2,從樣品B’得到樣品B’1和B’2。分(fēn)别收集每個峰并測定其總氮和總磷含量。各樣品的N/P值見表1.其中(zhōng)明治CPP-Ⅲ為(wèi)日本明治株式會社會社提供的樣品。CPP(g)為(wèi)廣州輕工(gōng)研究所提供的樣品。
表 1 各樣品的N/P值
樣品 | A* | B | A’ | B’ | A’1 | A’2 | B’1 | B’2 | 時治CPP-Ⅲ | CPP(g) | F |
N/P | 6.83 | 5.82 | 5.36 | 4.88 | 5.17 | 3.13 | 4.86 | 4.51 | 9.6 | 7.6 | 7.47 |
注:為(wèi)在真空幹燥過程中(zhōng)酪蛋白磷酸肽受熱凝結,同時将包含的溶液擠出。為(wèi)了加快幹燥過程曾除去這部分(fēn)溶液,此溶液中(zhōng)含較高的NPP,因此樣品A*的N/P低于用(yòng)冷凍幹燥所得的樣品F的N/P。
2.3 不同N/P值的CPPs阻止磷酸鈣沉澱形成的效果
在有(yǒu)CaCl2和Ca(H2PO4)2存在的溶液體(tǐ)系中(zhōng),Ca3(PO4)2的自發生成涉及下列反應[4]:
(1)Ca(H2PO4)2→CaHPO4-+H+
(2)3CaHPO4→Ca3(PO4)2+HPO42-+2H+
兩步反應都有(yǒu)H+釋放出來,所以可(kě)用(yòng)前述PH-Stat法間接檢測CPPs對這些反應的影響。為(wèi)使反應體(tǐ)系的PH保持在一指定值(PH7.2)而加入NaOH的速度(NaOH的加入量随時間而增加)較低時,可(kě)認為(wèi)反應體(tǐ)系中(zhōng)CPPs樣品阻止磷酸鈣沉澱形成的效果較好。
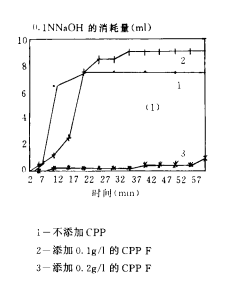
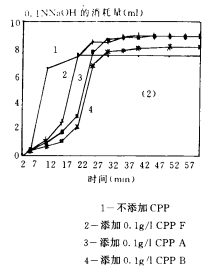
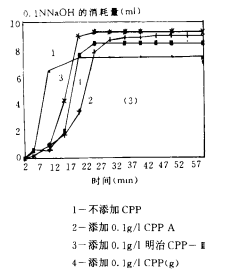
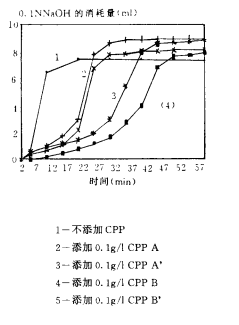

圖3(1-5) CPPs阻止磷酸鈣沉澱形成的效果
圖3(1)為(wèi)不添加CPPs和添加不同量的CPPs對磷酸鈣沉澱過程的影響。不添加CPPs時,磷酸鈣沉澱迅速形成,添加0.1g/l的CPP F幾乎可(kě)以完全阻止磷酸鈣沉澱形成。
圖3(2)是對N/P不同的CPPs阻止磷酸鈣沉澱形成的效果的比較。CPP A、B、F與對照相比都顯著地推遲了磷酸鈣沉澱的形成,N/P較小(xiǎo)的A和B樣品比N/P較大的F樣品效果更好。
圖3(3)比較了本實驗室制備的CPPA、日本明治CPP-Ⅲ和CPP(g)的效果。CPPA阻止沉澱形成的效果最好,其次是CPP(g),相比之下,明治CPP-Ⅲ的效果最差,但即使效果最差的CPP-Ⅲ也使沉澱過程推遲了5~10min。
圖3(4)是樣品A和B精(jīng)制前後效果的比較。經離子交換純化後樣品A和B的N/P下降1~1.5.純化後的樣品A’和B’阻止磷酸鈣沉澱形成的效果顯著增強,A’可(kě)使沉澱的大量形成延遲至30~40min,而B’使沉澱的大量形成延遲至更晚,直至40~45min是NaOH消耗量才快速上升。
圖3(5)比較了通過凝膠過濾得到的各部分(fēn)CPPs的效果。A’1和B’1對磷酸鈣沉澱形成的推遲作(zuò)用(yòng)都很(hěn)強,兩者相比,N/P較小(xiǎo)的B’1效果尤其強,而A’2和B’2對推遲磷酸鈣沉澱的形成也都有(yǒu)一定作(zuò)用(yòng),A’2使沉澱的形成由對照的5~10min推遲至15~25min,B’2則更遲至20~30min。
由以上分(fēn)析可(kě)知,對CPPs制品而言,添加量相同時,總的趨勢是N/P值較小(xiǎo)的樣品阻止磷酸鈣沉澱形成的效果好于N/P值較大的樣品。對于從凝膠過濾得到的部分(fēn),分(fēn)子量較大的A’1和B’1之間也有(yǒu)上述趨勢。這似乎可(kě)以說明,CPPs的效果與CPPs制品内磷酸基的密度有(yǒu)關,磷酸基密度較大,則效果較強。這一實驗結果與Sato等[5]以及Berrocal等[4]的實驗結果是一緻的。值得注意的是N/P值較小(xiǎo)的A’2和B’2的效果卻比N/P值較大的A’1和B’1差得多(duō);A’2和B’2比較,A’2比B’2的N/P值小(xiǎo)得多(duō),但A’2的效果卻比B’2差。這一結果與Mykkanen等的實驗結果有(yǒu)類似之處[6]。由此推知,CPPs的作(zuò)用(yòng)效果不僅和磷酸基的密度有(yǒu)關,還與CPPs的分(fēn)子結構密切相關。CPPs中(zhōng)氨基酸組成和排序不僅決定磷酸基的密度而且還決定磷酸基在肽鏈中(zhōng)的分(fēn)布。CPPs的分(fēn)子結構與其功能(néng)性質(zhì)的關系還有(yǒu)待實驗結果的進一步證實。我們深信這方面的研究工(gōng)作(zuò)将為(wèi)生産(chǎn)結構更為(wèi)合理(lǐ)的CPPs産(chǎn)品提供理(lǐ)論依據。
參考文(wén)獻
[1] Mellander H et al.Upsala Lakereforen Forhandl,1947,52:107~197
[2] Reeve R E.Science,1958,128:472
[3] Morrison W R.Anal.Biochem,1964,7:218~224
[4] Berrocal R et al.J.of Dairy Res.,1989,56:335~341
[5] Sato R et al.Agri.biol.chem.,1983,47(10):2415~2417
[6] Mykkanen H M,Wasserman R H.1980,110:2141~2148



